 Термическое разложение соединений солей железа (III) на воздухе: Обезвоживание метагидроксида железа прокаливанием: В природе — оксидные руды железа гематит Fe 2 O 3 и лимонит Fe 2 O 3 · n H 2 O. Применение. See more
Термическое разложение соединений солей железа (III) на воздухе: Обезвоживание метагидроксида железа прокаливанием: В природе — оксидные руды железа гематит Fe 2 O 3 и лимонит Fe 2 O 3 · n H 2 O. Применение. See more
 Физические свойства оксида железа (III), применение. Реакции: восстановление, получение солей с кислотами, сплавление с щелочами, конпропорционирование, вытеснение …
Физические свойства оксида железа (III), применение. Реакции: восстановление, получение солей с кислотами, сплавление с щелочами, конпропорционирование, вытеснение …
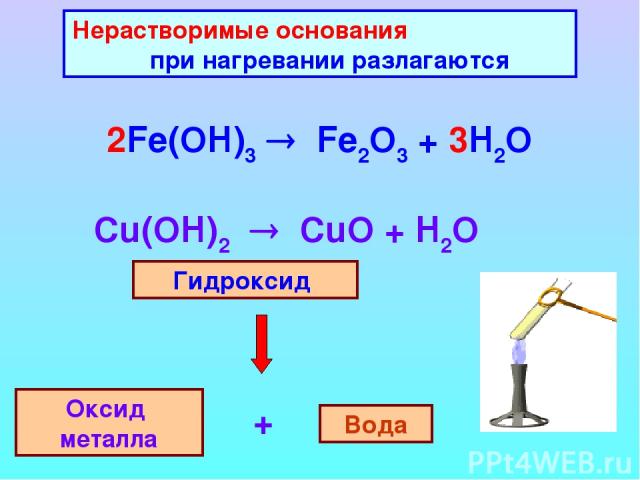
 Разложение гидроксида железа (III) при нагревании: 2Fe (OH)3 → Fe2O3 + 3H2O. Химические свойства. Оксид железа (III) – амфотерный. 1. При взаимодействии оксида железа (III) с кислотными …
Разложение гидроксида железа (III) при нагревании: 2Fe (OH)3 → Fe2O3 + 3H2O. Химические свойства. Оксид железа (III) – амфотерный. 1. При взаимодействии оксида железа (III) с кислотными …
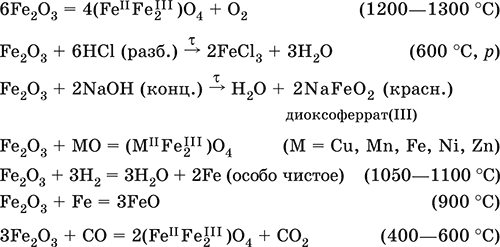 Оксид нужно нагреть до температуры 1400°С и более. В результате образуется соединение железная окалина - смесь двух оксидов железа разной степени окисления: 6Fe2O3 = …
Оксид нужно нагреть до температуры 1400°С и более. В результате образуется соединение железная окалина - смесь двух оксидов железа разной степени окисления: 6Fe2O3 = …
 Технология железоокисных пигментов предполагает 700-800°C для получения Fe2O3 из солей, а на газовой плите получается разогреть рабочий объем …
Технология железоокисных пигментов предполагает 700-800°C для получения Fe2O3 из солей, а на газовой плите получается разогреть рабочий объем …
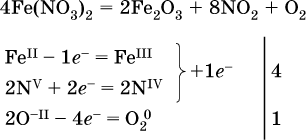 Оксид железа (III) – неорганическое вещество, имеет химическую формулу Fe2O3. Используется в металлургии для выплавки чугуна, как катализатор в химической …
Оксид железа (III) – неорганическое вещество, имеет химическую формулу Fe2O3. Используется в металлургии для выплавки чугуна, как катализатор в химической …
 Пирофорное железо при сгорании дает Fe2O3. Также его можно получить реакцией железного купороса с белизной и аккуратным прогревом выпавшего осадка …
Пирофорное железо при сгорании дает Fe2O3. Также его можно получить реакцией железного купороса с белизной и аккуратным прогревом выпавшего осадка …
 Химическая реакция диссоциация (разложение) гидроксида железа трехвалентного на оксид железа трехвалентный и воду. Графически это уравнение химической реакции …
Химическая реакция диссоциация (разложение) гидроксида железа трехвалентного на оксид железа трехвалентный и воду. Графически это уравнение химической реакции …
 Данный процесс может быть представлен следующим уравнением реакции: FeOH3 → Fe2O3 + H2O. Таким образом, разложение гидроксида железа (III) происходит при высокой температуре, в присутствии кислорода и под …
Данный процесс может быть представлен следующим уравнением реакции: FeOH3 → Fe2O3 + H2O. Таким образом, разложение гидроксида железа (III) происходит при высокой температуре, в присутствии кислорода и под …
 Известно шестнадцать различных оксидов железа, из них наиболее распространены и изучены три: Fe3O4 — сложный оксид, одновременно содержащий ионы железа (II) и …
Известно шестнадцать различных оксидов железа, из них наиболее распространены и изучены три: Fe3O4 — сложный оксид, одновременно содержащий ионы железа (II) и …
 Окси́д желе́за — за́кись-о́кись железа, желе́зная ока́лина — неорганическое соединение, двойной оксид металла железа с формулой Fe 3 O 4 {\displaystyle {\ce {Fe3O4}}} или FeO …
Окси́д желе́за — за́кись-о́кись железа, желе́зная ока́лина — неорганическое соединение, двойной оксид металла железа с формулой Fe 3 O 4 {\displaystyle {\ce {Fe3O4}}} или FeO …
 fe2o3 → x → y. веществами x и y являются: 1. Сульфат железа (ii) 2. Сульфит железа (iii) 3. Сульфат железа (iii) 4. Сульфид железа (ii) 5. Железо. Решение: 1. fe2o3 + …
fe2o3 → x → y. веществами x и y являются: 1. Сульфат железа (ii) 2. Сульфит железа (iii) 3. Сульфат железа (iii) 4. Сульфид железа (ii) 5. Железо. Решение: 1. fe2o3 + …
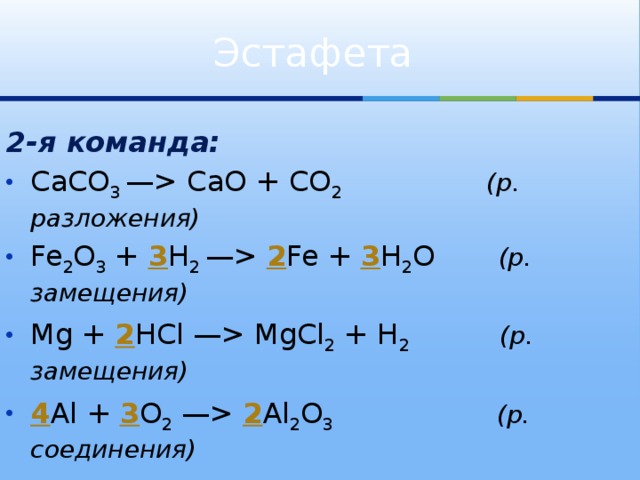
 Расставьте коэффициенты, определи тип каждой реакции – соединение, разложение, замещение, обмена : 1) Fe(OH)3 = Fe2O3 + H2O; 2)Mg(OH)2 + HCl = MgCl2 + H2O; 3)ZnO …
Расставьте коэффициенты, определи тип каждой реакции – соединение, разложение, замещение, обмена : 1) Fe(OH)3 = Fe2O3 + H2O; 2)Mg(OH)2 + HCl = MgCl2 + H2O; 3)ZnO …
 Получается следующее. 4Fe (NO 3) 3 = 2Fe 2 O 3 + 4NO 2 + 11O 2 . Данная реакция называется реакцией разложения. В этой реакции происходит разложение нитрата …
Получается следующее. 4Fe (NO 3) 3 = 2Fe 2 O 3 + 4NO 2 + 11O 2 . Данная реакция называется реакцией разложения. В этой реакции происходит разложение нитрата …
 Решенное и коэффициентами уравнение реакции Fe2O3 → 2 Fe + O3 с дополненными продуктами. Приложение для вычисления и дополнения продуктов реакции.
Решенное и коэффициентами уравнение реакции Fe2O3 → 2 Fe + O3 с дополненными продуктами. Приложение для вычисления и дополнения продуктов реакции.
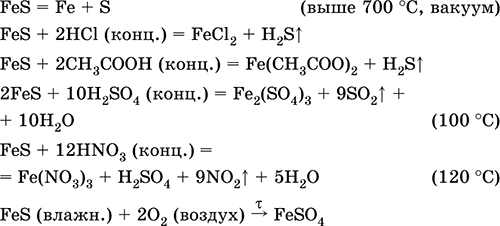 Расширенный поиск. Или Попробуйте случайную реакцию. Приложение для вычисления и дополнения продуктов реакции. Ионные и окислительно-восстановительные реакции!
Расширенный поиск. Или Попробуйте случайную реакцию. Приложение для вычисления и дополнения продуктов реакции. Ионные и окислительно-восстановительные реакции!
Еще по теме:









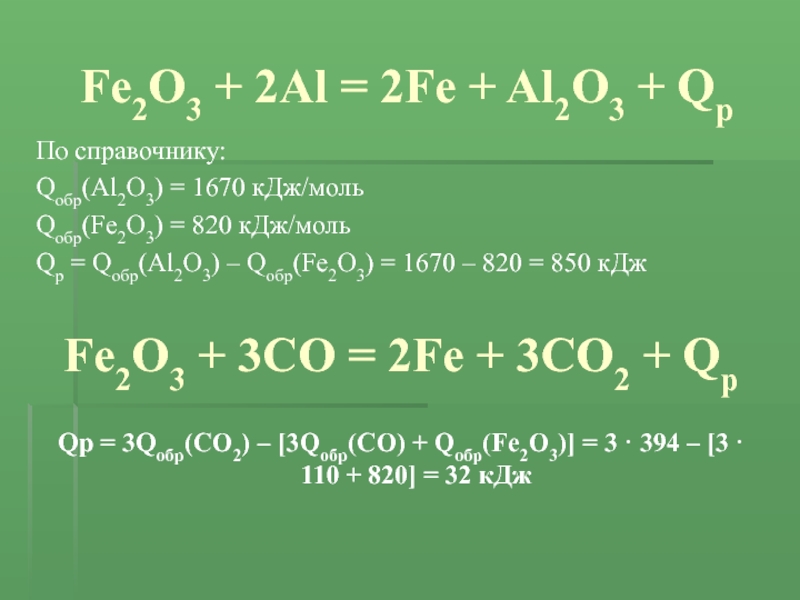



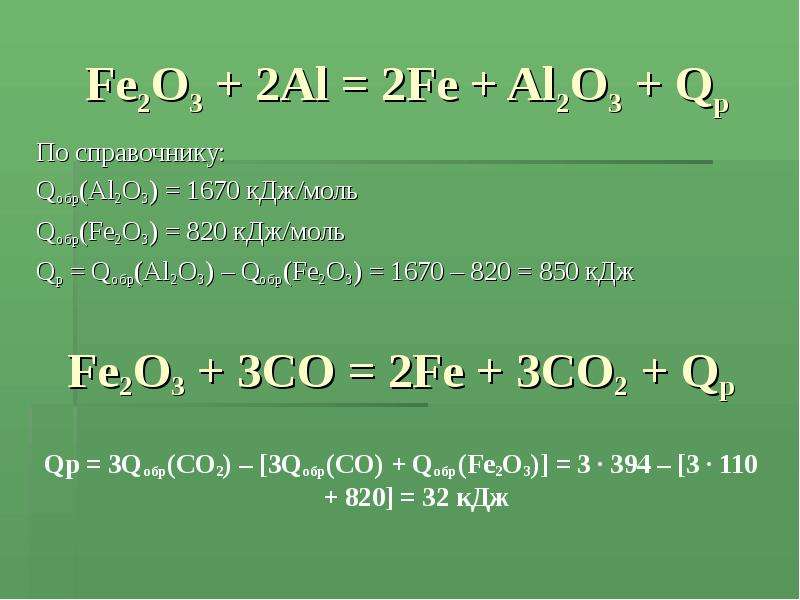
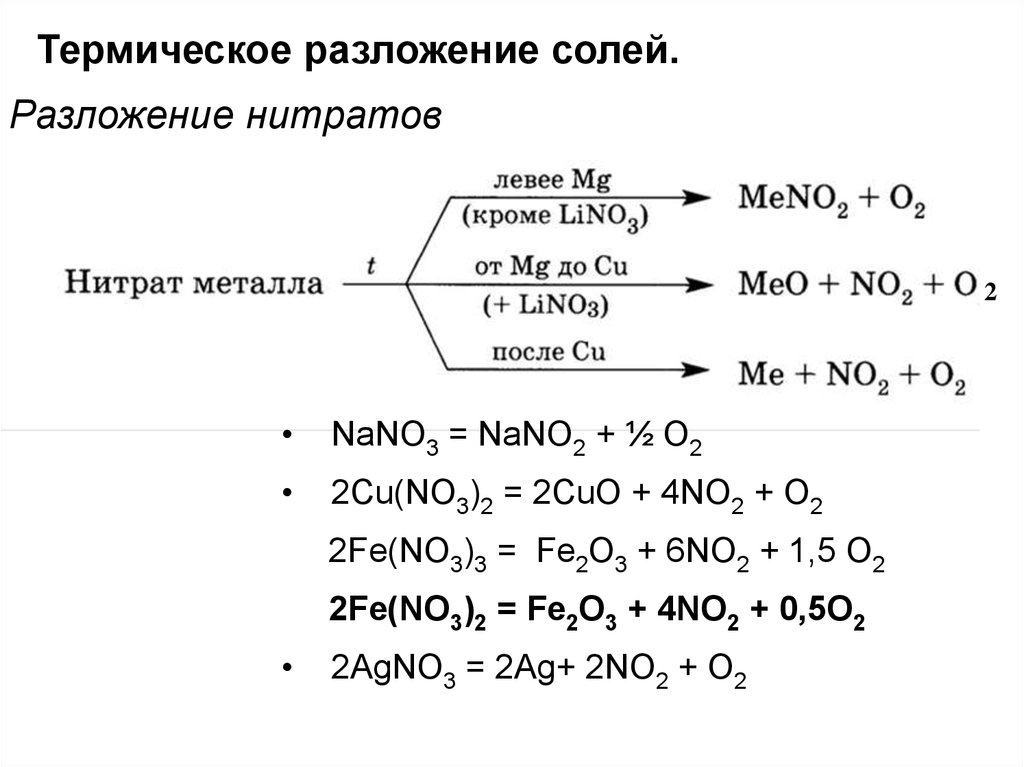
Еще по теме: