Решенное и коэффициентами уравнение реакции 2 SO2 + O2 → 2 SO3 с дополненными продуктами.
Решенное и коэффициентами уравнение реакции 2 SO2 + O2 → 2 SO3 с дополненными продуктами.
 May 26, 2014. The balanced equation is 2SO2 + O2 → 2SO3. Explanation: You follow a systematic procedure to balance the equation. Start with the unbalanced equation: SO2 + O2 …
May 26, 2014. The balanced equation is 2SO2 + O2 → 2SO3. Explanation: You follow a systematic procedure to balance the equation. Start with the unbalanced equation: SO2 + O2 …
 In the reaction, 2SO2(g)+O2(g)→2SO3(g), when 1 mole of SO2 and 1 mole of O2 are made to react to completion: Q. 2SO2+O2⇌2SO3. Starting with 2 moles SO2 and 1 mole O2 in 1 L flask, mixture required 0.4 mole M nO4− in acidic …
In the reaction, 2SO2(g)+O2(g)→2SO3(g), when 1 mole of SO2 and 1 mole of O2 are made to react to completion: Q. 2SO2+O2⇌2SO3. Starting with 2 moles SO2 and 1 mole O2 in 1 L flask, mixture required 0.4 mole M nO4− in acidic …
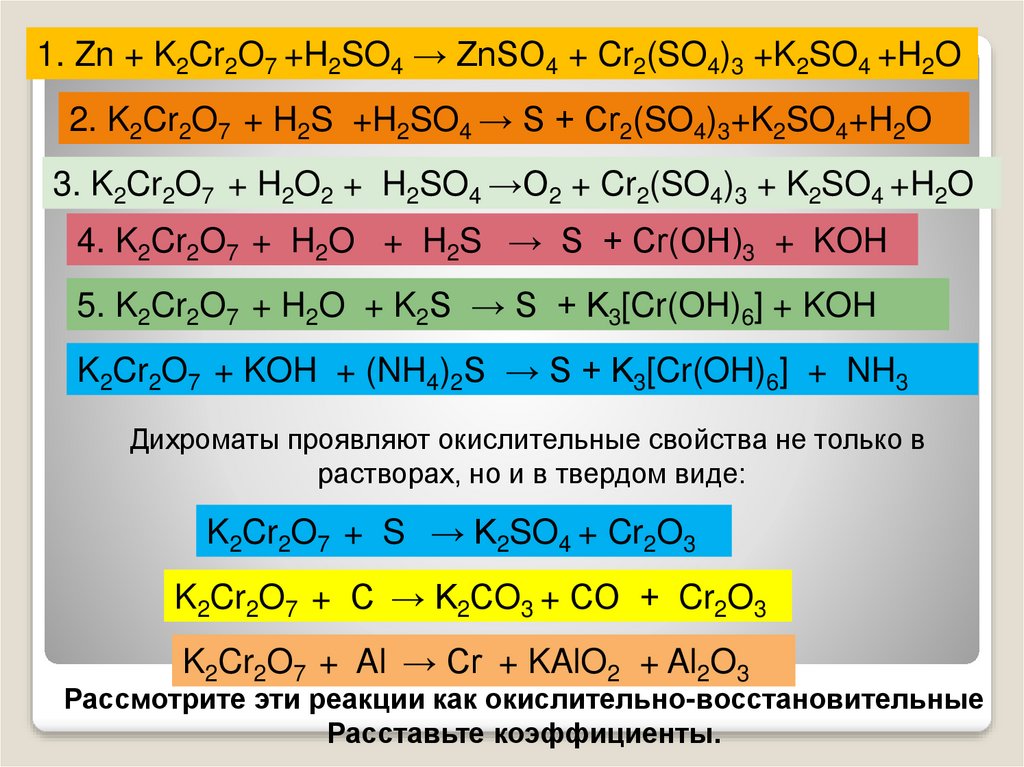
 Решение #1. Рассмотрим вариант решения задания из учебника Рудзитис, Фельдман 9 класс, Просвещение: 3. На смешение химического равновесия реакции. 2SO2 + O2 <=> 2SO3 + Q.
Решение #1. Рассмотрим вариант решения задания из учебника Рудзитис, Фельдман 9 класс, Просвещение: 3. На смешение химического равновесия реакции. 2SO2 + O2 <=> 2SO3 + Q.
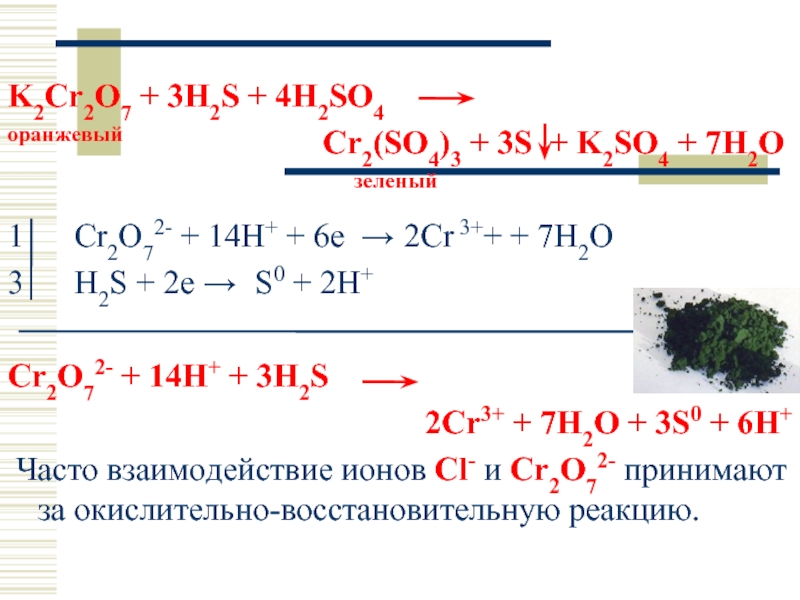
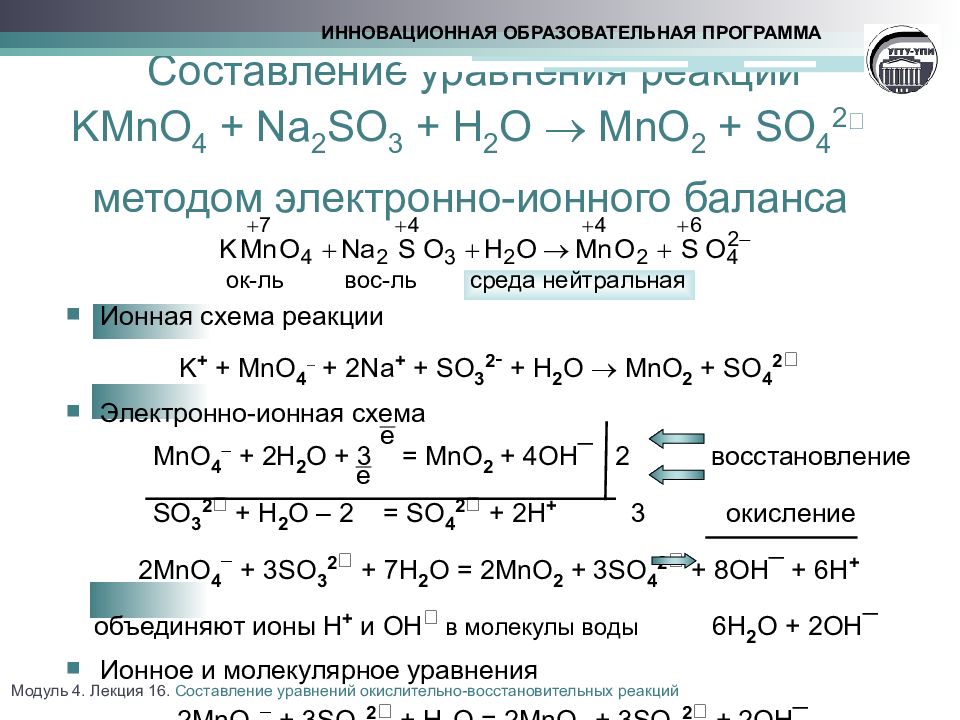
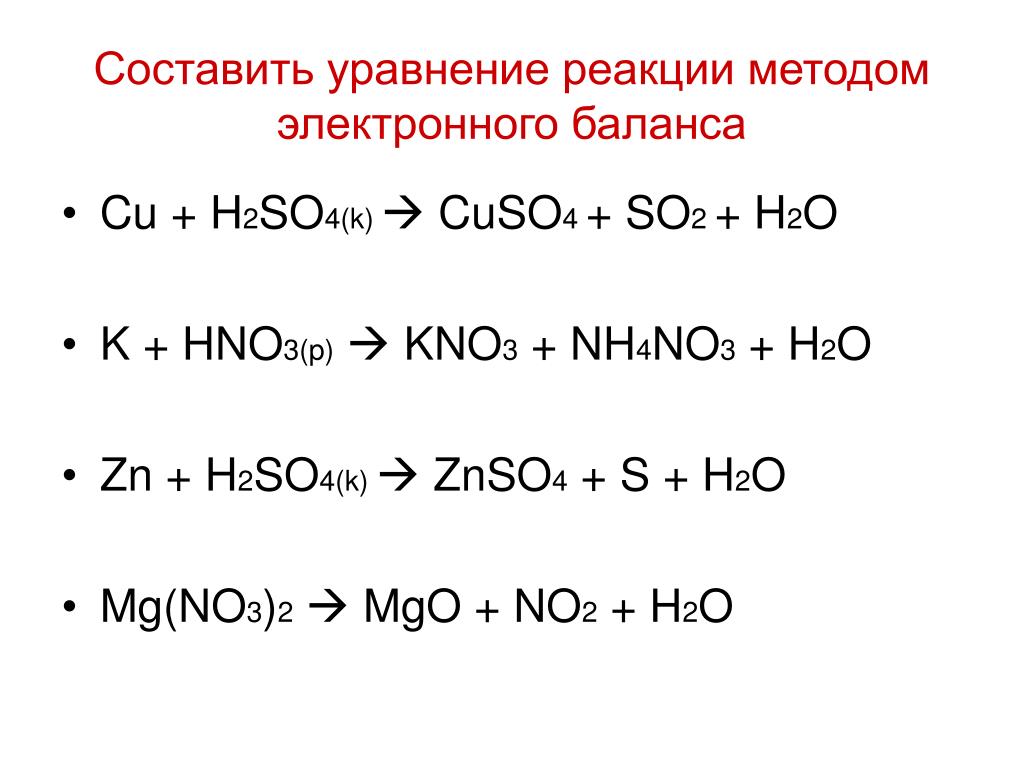
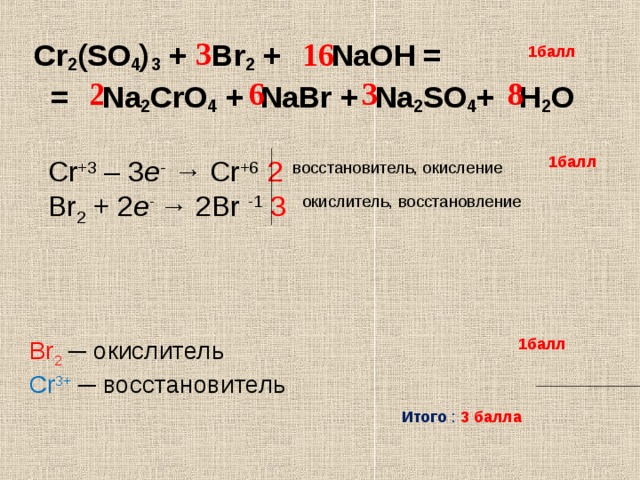
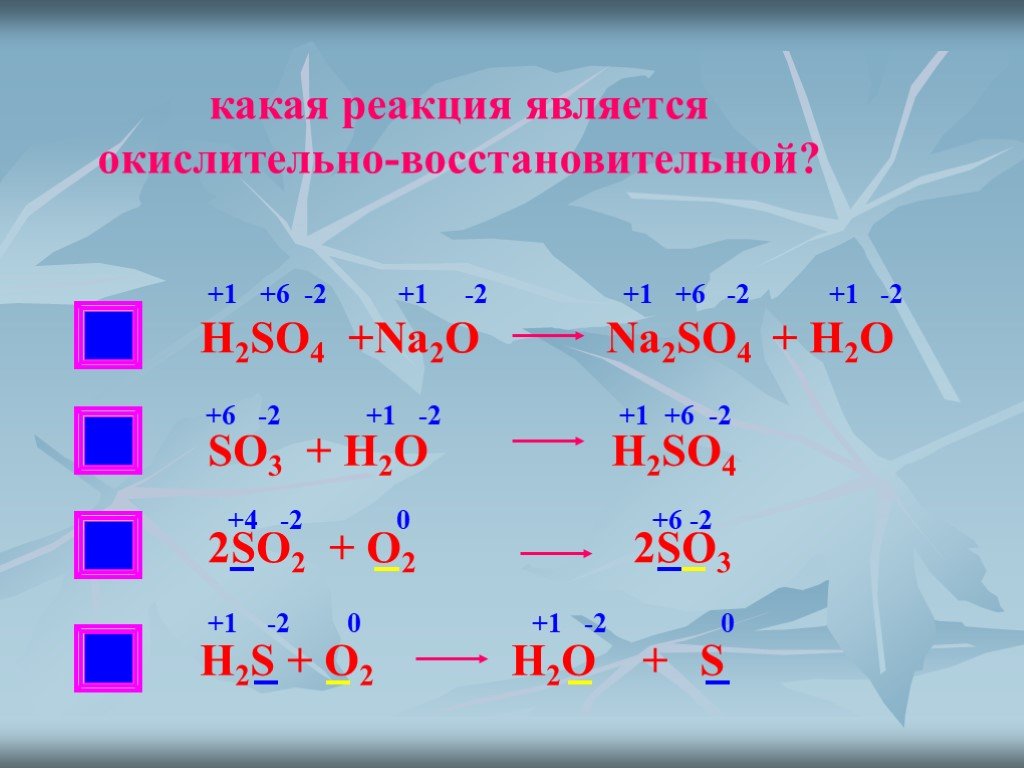
 so2 + o2 = so3. S (+4) - 2ē = S (+6). | 2 | 4 | 2 — коэффициент перед веществом. S — восстановитель, реакция окисления.
so2 + o2 = so3. S (+4) - 2ē = S (+6). | 2 | 4 | 2 — коэффициент перед веществом. S — восстановитель, реакция окисления.
 The stoichiometry calculator above shows the mole ratios/coefficients of the balanced equation, 2SO2 + O2 = 2SO3. Enter the amount of any of the substances to determine the ideal …
The stoichiometry calculator above shows the mole ratios/coefficients of the balanced equation, 2SO2 + O2 = 2SO3. Enter the amount of any of the substances to determine the ideal …
 Дайте Характеристику реакции 2SO2+O2=2SO3. Артём Корниенко Ученик (174), закрыт 11 лет назад. 1)по числу и составу исходных веществ и продуктов реакции. 2)по тепловому …
Дайте Характеристику реакции 2SO2+O2=2SO3. Артём Корниенко Ученик (174), закрыт 11 лет назад. 1)по числу и составу исходных веществ и продуктов реакции. 2)по тепловому …
 At 450 K, Kp = 2.0 × 10^10/bar for the given reaction at equilibrium. 2SO2(g) + O2(g) ⇌ 2SO3(g) + 189.4 kJ
At 450 K, Kp = 2.0 × 10^10/bar for the given reaction at equilibrium. 2SO2(g) + O2(g) ⇌ 2SO3(g) + 189.4 kJ
 At 450 K, Kp = 2.0 × 10^10/bar for the given reaction at equilibrium. 2SO2(g) + O2(g) ⇌ 2SO3(g) + 189.4 kJ
At 450 K, Kp = 2.0 × 10^10/bar for the given reaction at equilibrium. 2SO2(g) + O2(g) ⇌ 2SO3(g) + 189.4 kJ
 Рассчитать Кс реакции 2SO2 (г) + O2 (г) = 2SO3 (г), если начальные концентрации SO2 и O2 (моль/л) соответственно равны 2 и 4 и к моменту равновесия прореагировало 25% …
Рассчитать Кс реакции 2SO2 (г) + O2 (г) = 2SO3 (г), если начальные концентрации SO2 и O2 (моль/л) соответственно равны 2 и 4 и к моменту равновесия прореагировало 25% …
 To calculate the limiting reagent in SO2 + O2 = SO3 you must first find the stoichiometric mole ratios of each compound. This can be done by using our chemical equation balancer and …
To calculate the limiting reagent in SO2 + O2 = SO3 you must first find the stoichiometric mole ratios of each compound. This can be done by using our chemical equation balancer and …
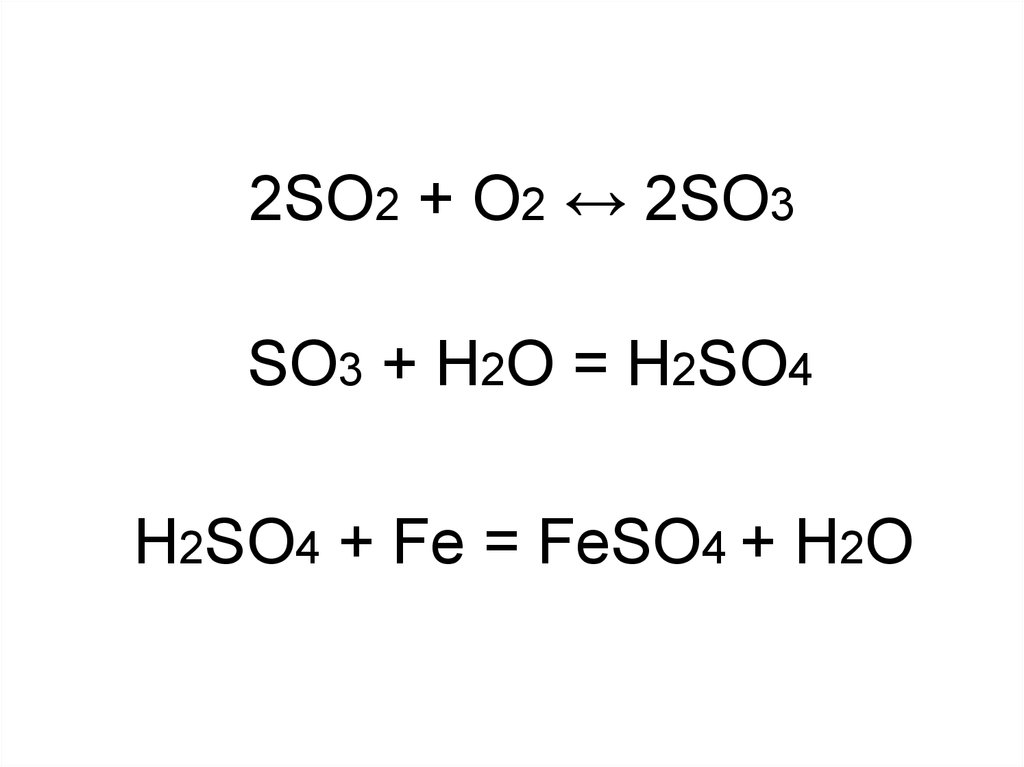
 Polymer. An ampoule of sulfur trioxide. If SO 3 is condensed above 27 °C, then α -SO 3 forms, which has a melting point of 62.3 °C. α -SO 3 is fibrous in appearance. Structurally, it is the …
Polymer. An ampoule of sulfur trioxide. If SO 3 is condensed above 27 °C, then α -SO 3 forms, which has a melting point of 62.3 °C. α -SO 3 is fibrous in appearance. Structurally, it is the …
 Лучший ответ. Анна Мудрец (11830) 11 лет назад. 2SO2 (г) + O2 (г) = 2SO3 (г) Молярная концентрация гомогенной реакции, протекающей в газовой фазе, обратно …
Лучший ответ. Анна Мудрец (11830) 11 лет назад. 2SO2 (г) + O2 (г) = 2SO3 (г) Молярная концентрация гомогенной реакции, протекающей в газовой фазе, обратно …
 The equilibrium constant Kp of the reaction, 2SO2(g) + O2(g) ⇋ 2SO3(g) is 900 atm at 800K. A mixture containing SO3 and O2 having initial pressure of 1 and 2 atm respectively …
The equilibrium constant Kp of the reaction, 2SO2(g) + O2(g) ⇋ 2SO3(g) is 900 atm at 800K. A mixture containing SO3 and O2 having initial pressure of 1 and 2 atm respectively …
 Since reaction is exothermic it is favoured at low temperature. There is a decrease in number of moles hence reaction is favoured at high pressure. The reaction 2 SO 2+ O 2 leftharpoons 2 …
Since reaction is exothermic it is favoured at low temperature. There is a decrease in number of moles hence reaction is favoured at high pressure. The reaction 2 SO 2+ O 2 leftharpoons 2 …
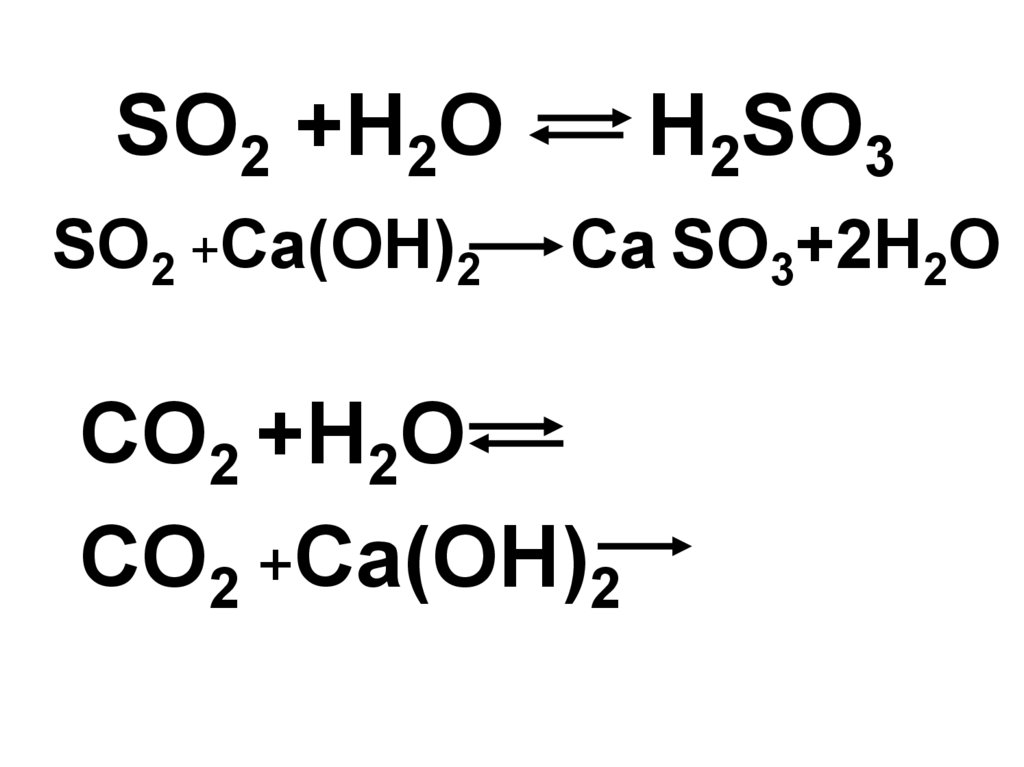
Еще по теме:
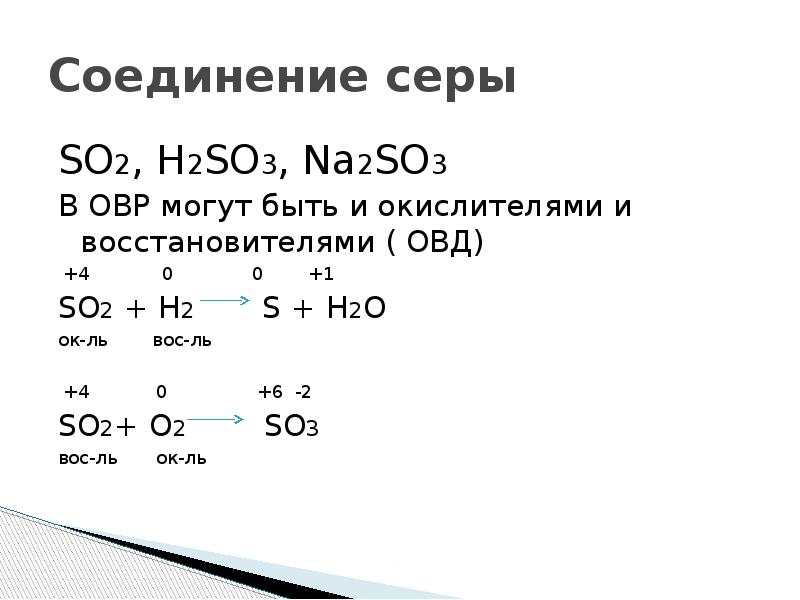







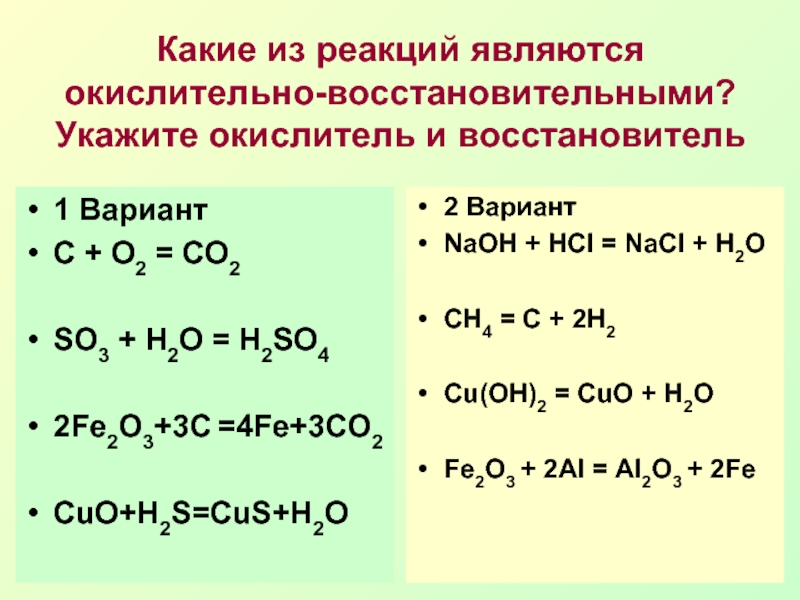




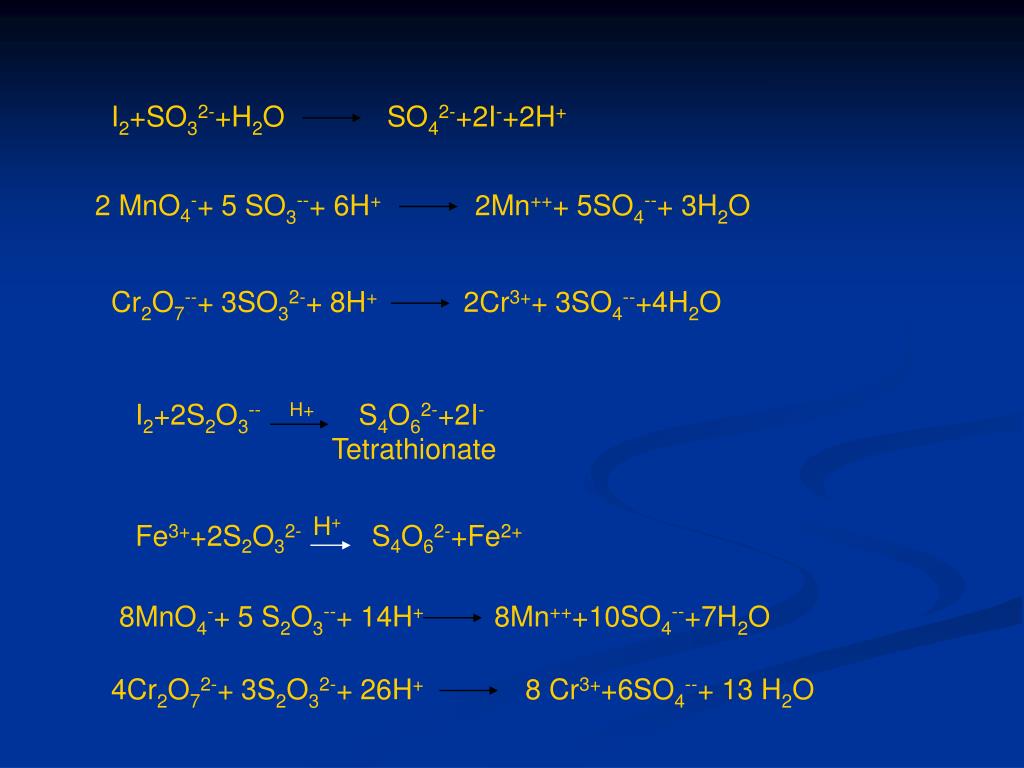

Еще по теме: